LEYES DE LOS GASES
Leyes de los gases
Ejercicios de química
Introducción A continuación, se desarrollara un laboratorio de química
(GASES) se realizara un laboratorio por cada ley y continuo a esto una serie de
ejercicios para reforzar la temática vista.
Objetivos:
· Dar conocer las diferentes leyes (LEY DE BOYLE, CHARLES, AVOGADRO, GASES IDEALES, GAY- LUSSAC Y GENERALIZADA).
· Dar conocer las diferentes leyes (LEY DE BOYLE, CHARLES, AVOGADRO, GASES IDEALES, GAY- LUSSAC Y GENERALIZADA).
· · Ser una útil herramienta teórica y de
aprendizaje en línea, ayudando al usuario a comprender mejor ciertos procesos
químicos.
· ·
Reforzar los conocimientos acerca de las leyes
de los gases.
· · Realizar correctamente ejercicios acerca de
estas.
Marco Teórico:
AMEDEO AVOGADRO
Químico y físico italiano. Nació el 9 de junio de 1776 en
Turín, Italia y murió el 9 de julio de 1856.
En 1792 se graduó como doctor en derecho canónico, pero no
ejerció. En vez de ello, mostró verdadera pasión por la física y la química, y
una gran destreza para las matemáticas.
Recapacitando sobre el
descubrimiento de Charles (publicado por Gay -Lussac) de que todos los gases se
dilatan en la misma proporción con la temperatura decidió que esto debía
implicar que cualquier gas a una temperatura dada debía contener el mismo
número de partículas por unidad de volumen. Avogadro tuvo la precaución de
especificar que las partículas no tenían por qué ser átomos individuales sino
que podían ser combinaciones de átomos (lo que hoy llamamos moléculas).
Con esta consideración
pudo explicar con facilidad la ley de la combinación de volúmenes que había
sido anunciada por Gay-Lussac y, basándose en ella, dedujo que el oxígeno era
16 veces más pesado que el hidrógeno y no ocho como defendía Dalton en aquella
época.
Enunció la llamada
hipótesis de Avogadro: iguales volúmenes de gases distintos contienen el mismo
número de moléculas, si ambos se encuentran a igual temperatura y presión.
Ese número, equivalente a
6,022· 1023, es constante, según publicó en 1811. Como ha ocurrido
muchas veces a lo largo de la historia las propuestas de Avogadro no fueron
tomadas en cuenta, es más, Dalton, Berzelius y otros científicos de la época
despreciaron la validez de su descubrimiento y la comunidad científica no
aceptó de inmediato las conclusiones de Avogadro por tratarse de un
descubrimiento basado en gran medida en métodos empíricos y válido solamente
para los gases reales sometidos a altas temperaturas pero a baja presión.
Sin embargo, la ley de
Avogadro permite explicar por qué los gases se combinan en proporciones
simples.
Fue su paisano Cannizaro
quién, 50 años más tarde, se puso a su favor y la hipótesis de Avogadro empezó
a ser aceptada. A partir de entonces empezó a hablarse del número Avogadro.
LEY DE AVOGADRO
Relación entre la cantidad de
gas y su volumen
Esta ley, descubierta por
Avogadro a principios del siglo XIX, establece la relación entre la cantidad de
gas y su volumen cuando se mantienen constantes la temperatura y la presión.
Recuerda que la cantidad
de gas la medimos en moles.
¿Por qué ocurre esto?
Vamos a suponer que aumentamos
la cantidad de gas. Esto quiere decir que al haber mayor número de moléculas
aumentará la frecuencia de los choques con las paredes del recipiente lo que
implica (por un instante) que la presión dentro del recipiente
es mayor que la exterior y esto provoca que el émbolo se desplace hacia arriba
inmediatamente. Al haber ahora mayor distancia entre las paredes (es decir,
mayor volumen del recipiente) el número de choques de las moléculas contra las
paredes disminuye y la presión vuelve a su valor original.
Según hemos visto en la
animación anterior, también podemos expresar la ley de Avogadro así:
V/n=k
(el cociente entre el volumen y
la cantidad de gas es constante)
Supongamos que tenemos una
cierta cantidad de gas n1 que ocupa un volumen V1 al
comienzo del experimento. Si variamos la cantidad de gas hasta un nuevo valor n2,
entonces el volumen cambiará a V2, y se cumplirá:
V1/n1=
V2/n2
que es otra manera de expresar
la ley de Avogadro.
ROBERT BOYLE
Nacido en 1627, el menor de los
catorce hijos del conde de Cork, estudió en las mejores universidades de
Europa. Descubrió los indicadores, sustancias que permiten distinguir los
ácidos de las bases. En 1659, con la ayuda de Robert Hooke, descubrió la ley
que rige el comportamiento de los muelles, perfeccionó la bomba de aire para
hacer el vacío que se utilizó en la minería para eliminar el agua de las
galerías en las que trabajan los mineros.
Atacó a la Alquimia y a los
alquimistas, que anunciaban que podían convertir cualquier metal en oro.
Definió la Química como una
ciencia y enunció la primera definición moderna de elemento químico, como
sustancia que no es posible descomponer en otras.
En 1661 publicó el primer libro
moderno de química El Químico Escéptico en el que explicaba la mayoría de sus
descubrimientos. Fue miembro de la Royal Society, institución que perdura en la
actualidad, y participó activamente en sus reuniones hasta su fallecimiento.
En 1660, en una obra
titulada Sobre la Elasticidad del Aire anunció su
descubrimiento sobre la relación entre el volumen de un gas y su presión.
Parece que Boyle no especificó
en sus trabajos que sus experiencias de la relación entre el volumen y presión
los realiza a temperatura constante, quizá porque lo hizo así y lo dió por
supuesto. Lo cierto es que, en defensa del rigor científico, hay que esperar a
que en 1676 otro físico, el francés Edme Mariotte (1630-1684), encuentre de
nuevo los mismos resultados y aclare que la relación PV=constante es
sólo válida si se mantiene constante la temperatura. Por eso la ley de Boyle
está referenciada en muchas ocasiones como Ley de Boyle y Mariotte.
LEY DE BOYLE
Relación entre la presión y el
volumen de un gas cuando la temperatura es constante
Fue descubierta por Robert
Boyle en 1662. Edme Mariotte también llegó a la misma conclusión que Boyle,
pero no publicó sus trabajos hasta 1676. Esta es la razón por la que en muchos
libros encontramos esta ley con el nombre de Ley de Boyle y Mariotte.
La ley de Boyle establece que
la presión de un gas en un recipiente cerrado es inversamente proporcional al
volumen del recipiente, cuando la temperatura es constante.
¿Por qué
ocurre esto?
Al aumentar el volumen, las
partículas (átomos o moléculas) del gas tardan más en llegar a las paredes del
recipiente y por lo tanto chocan menos veces por unidad de tiempo contra ellas.
Esto significa que la presión será menor ya que ésta representa la frecuencia
de choques del gas contra las paredes.
Cuando disminuye el volumen la
distancia que tienen que recorrer las partículas es menor y por tanto se
producen más choques en cada unidad de tiempo: aumenta la presión.
Lo que Boyle descubrió es que
si la cantidad de gas y la temperatura permanecen constantes, el producto de la
presión por el volumen siempre tiene el mismo valor.
Como hemos visto, la expresión
matemática de esta ley es:
P⋅V=k
(el producto de la presión por
el volumen es constante)
Supongamos que tenemos un
cierto volumen de gas V1 que se encuentra a una presión P1 al
comienzo del experimento. Si variamos el volumen de gas hasta un nuevo valor V2,
entonces la presión cambiará a P2, y se cumplirá:
P1⋅V1=P2⋅V2
que es otra manera de expresar
la ley de Boyle
JACQUES CHARLES
Jacques Alexandre César Charles, químico, físico y
aeronauta francés, nació en Beaugency (Loiret) el 2 de noviembre de 1746 y
falleció en París el 7 de abril de 1823.
Al tener noticias de las experiencias de los hermanos
Montgolfier con su globo aerostático propuso la utilización del hidrógeno, que
era el gas más ligero que se conocía entonces, como medio más eficiente que el
aire para mantener los globos en vuelo.
En 1783 construyó los primeros globos de hidrógeno y subió
él mismo hasta una altura de unos 2 km, experiencia que supuso la locura por la
aeronáutica que se desató en la época.
Su descubrimiento más importante fue en realidad un
redescubrimiento ya que en 1787 retomó un trabajo anterior de Montons y
demostró que los gases se expandían de la misma manera al someterlos a un mismo
incremento de temperatura.
El paso que avanzó Charles fue que midió con más o menos
exactitud el grado de expansión observó que por cada grado centígrado de
aumento de la temperatura el volumen del gas aumentaba 1/275 del que tenía a
0°C . Esto significaba que a una temperatura de -275 °C el volumen de un gas sería
nulo (según dicha ley) y que no podía alcanzarse una temperatura más baja.
Dos generaciones más tarde Kelvin fijó estas ideas
desarrollando la escala absoluta de temperaturas y definiendo el concepto de
cero absoluto.
Charles no público sus experimentos y hacia 1802
Gay-Lussac publicó sus observaciones sobre la relación entre el volumen y la
temperatura cuando se mantiene constante la presión por lo que a la ley de
Charles también se le llama a veces ley de Charles y Gay-Lussac.
LEY DE CHARLES
Relación entre la temperatura y
el volumen de un gas cuando la presión es constante
En 1787, Jack Charles estudió
por primera vez la relación entre el volumen y la temperatura de una muestra de
gas a presión constante y observó que cuando se aumentaba la temperatura el
volumen del gas también aumentaba y que al enfriar el volumen disminuía.
¿Por qué
ocurre esto?
Cuando aumentamos la
temperatura del gas las moléculas se mueven con más rapidez y tardan menos
tiempo en alcanzar las paredes del recipiente. Esto quiere decir que el número
de choques por unidad de tiempo será mayor. Es decir se producirá un aumento
(por un instante) de la presión en el interior del recipiente y aumentará el
volumen (el émbolo se desplazará hacia arriba hasta que la presión se iguale
con la exterior).
Lo que Charles descubrió es que
si la cantidad de gas y la presión permanecen constantes, el cociente entre el
volumen y la temperatura siempre tiene el mismo valor.
Matemáticamente podemos
expresarlo así:
VT=k
(el cociente entre el volumen y
la temperatura es constante)
Supongamos que tenemos un
cierto volumen de gas V1 que se encuentra a una temperatura T1 al
comienzo del experimento. Si variamos el volumen de gas hasta un nuevo valor V2,
entonces la temperatura cambiará a T2, y se cumplirá:
V1T1=V2T2
que es otra manera de expresar
la ley de Charles.
Esta ley se descubre casi
ciento cuarenta años después de la de Boyle debido a que cuando Charles la
enunció se encontró con el inconveniente de tener que relacionar el volumen con
la temperatura Celsius ya que aún no existía la escala absoluta de
temperatura.
JOSEPH LOUIS GAY-LUSSAC
Químico y físico francés,
nacido el 6 de diciembre de 1778, en Saint-Léonard-de-Noblat, y fallecido el 9
de mayo de 1850, en París.
Además de ocupar cargos
políticos de importancia, Gay-Lussac fue catedrático de Física (a partir de
1808) en la Universidad de la Sorbona, así como catedrático de Química (a
partir de 1809) en el Instituto Politécnico de París.
En 1802 publicó los resultados
de sus experimentos que, ahora conocemos como Ley de Gay-Lussac. Esta ley
establece, que, a volumen constante, la presión de una masa fija de un gas dado
es directamente proporcional a la temperatura Kelvin.
En el campo de la física llevó
a cabo, en 1804, dos ascensiones en globo, hasta altitudes de 7.000 metros, en
las que estudió la composición de las capas altas de la atmósfera y el
magnetismo terrestre.
Entre 1805 y 1808 dió a conocer
la ley de los volúmenes de combinación, que afirma que los volúmenes de
los gases que intervienen en una reacción química (tanto de reactivos como de
productos) están en la proporción de números enteros sencillos.
En relación con estos estudios,
investigó junto con el naturalista alemán Alexander von Humboldt, la
composición del agua, descubriendo que se compone de dos partes de hidrógeno
por una de oxígeno.
En 1811 dió forma a la ley que
Charles había descubierto en 1787 sobre la relación entre el volumen y la
temperatura, pero que había quedado sin publicar. Este mismo año, el químico
francés Courtois, por medio de una reacción química produjo un gas de color
violeta que Gay-Lussac identificó como un nuevo elemento y le dio el nombre de
yodo, que en griego significa violeta.
Estudió también el ácido
cianhídrico así como el gas de hulla. En el año 1835 creó un procedimiento para
la producción de ácido sulfúrico basado en el empleo de la torre llamada de
Gay-Lussac.
Gracias a sus mediciones
químicas de precisión y a sus procedimientos exactos de trabajo, logró obtener
varios elementos químicos y establecer las bases del análisis volumétrico
convirtiéndolo en una disciplina independiente.
En la lucha de prestigio entre
Francia e Inglaterra, Napoleón suministró fondos a Gay-Lussac para que
construyera una batería eléctrica mayor que la de Davy, y así encontrar nuevos
elementos.
La batería no fue necesaria,
pues Gay-Lussac y Thenard empleando el potasio descubierto por Davy, aislaron
el boro sin necesidad de la electricidad. Al tratar óxido de boro con potasio
se produjo el elemento boro.
En 1809 Gay-Lussac trabajó en
la preparación del potasio e investigó las propiedades del cloro. En el campo
de la industria química desarrolló mejoras en varios procesos de fabricación y
ensayo. En 1831 fue elegido miembro de la Cámara de los Diputados y en 1839 del
Senado.
LEY DE GAY- LUSSAC
Fue
enunciada por Joseph Louis Gay-Lussac a principios de 1800.
Establece la relación entre la temperatura y la presión de un gas cuando el volumen es constante
Establece la relación entre la temperatura y la presión de un gas cuando el volumen es constante
¿Por qué
ocurre esto?
Al aumentar la temperatura las
moléculas del gas se mueven más rápidamente y por tanto aumenta el número de
choques contra las paredes, es decir aumenta la presión ya que el recipiente es
de paredes fijas y su volumen no puede cambiar.
Gay-Lussac descubrió que, en
cualquier momento de este proceso, el cociente entre la presión y la
temperatura siempre tenía el mismo valor:
PT=k
(el cociente entre la presión y
la temperatura es constante)
Supongamos que tenemos un gas
que se encuentra a una presión P1 y a una temperatura T1 al
comienzo del experimento. Si variamos la temperatura hasta un nuevo valor T2,
entonces la presión cambiará a P2, y se cumplirá:
P1T1=P2T2
que es otra
manera de
expresar la ley de Gay-Lussac.
Esta ley, al igual que la de Charles,
está expresada en función de la temperatura absoluta. Al igual que en la ley de
Charles, las temperaturas
han de expresarse en Kelvin.
LEY DE LOS GASES IDEALES
La ley de los gases ideales es
la ecuación de estado del gas ideal, un gas hipotético formado por partículas
puntuales sin atracción ni repulsión entre ellas y cuyos choques son
perfectamente elásticos (conservación de momento y energía cinética). La energía
cinética es directamente proporcional a la temperatura en un gas ideal.
Los gases reales que más se
aproximan al comportamiento del gas ideal son los gases monoatómicos en condiciones de baja presión y alta
temperatura.
En 1648, el químico Jan Baptista van Helmont creó
el vocablo gas, a partir del término griego kaos (desorden) para
definir las génesis características del anhídrido carbónico. Esta
denominación se extendió luego a todos los cuerpos gaseosos y se utiliza para
designar uno de los estados de la materia.
La presión ejercida por una fuerza física es
inversamente proporcional al volumen de una masa gaseosa, siempre y cuando su
temperatura se mantenga constante. o en términos más sencillos:
A temperatura constante, el volumen de una masa
fija de gas es inversamente proporcional a la presión que este ejerce.
Matemáticamente se puede expresar así:
donde k es constante si la
temperatura y la masa del gas permanecen constantes.
Cuando aumenta la presión, el volumen baja,
mientras que si la presión disminuye el volumen aumenta. No es necesario
conocer el valor exacto de la constante k para poder hacer uso
de la ley: si consideramos las dos situaciones de la figura, manteniendo
constante la cantidad de gas y la temperatura, deberá cumplirse la relación:
Las primeras leyes de los gases fueron
desarrollados desde finales del siglo XVII, aparentemente de manera
independiente por August Krönig en 18561 y Rudolf Clausius en 1857.2 La constante universal de los gases se
descubrió y se introdujo por primera vez en la ley de los gases ideales en lugar
de un gran número de constantes de gases específicas descriptas por Dmitri Mendeleev en 1874.
LEY GENERALIZADA
DE LOS GASES
La ley combinada de los gases o ley
general de los gases es una ley de los gases que combina
la ley de Boyle, la ley de Charles y la ley de Gay-Lussac. Estas leyes matemáticamente se refieren a cada
una de las variables termodinámicas con relación a otra mientras todo lo demás
se mantiene constante. La ley de Charles establece que el volumen y la temperatura son directamente proporcionales entre sí,
siempre y cuando la presión se mantenga constante. La ley de Boyle afirma que
la presión y el volumen son inversamente proporcionales entre sí a
temperatura constante. Finalmente, la ley de Gay-Lussac introduce una
proporcionalidad directa entre la temperatura y la presión, siempre y cuando se
encuentre a un volumen constante. La interdependencia de estas variables se
muestra en la ley de los gases combinados, que establece claramente que:
La relación entre el producto presión-volumen y la
temperatura de un sistema permanece constante.
Matemáticamente puede formularse como:
PV/T= K
donde:
·
P es la presión
·
V es el volumen
·
T es la temperatura absoluta
(en kelvins)
·
K es una constante
(con
unidades de energía dividido por la temperatura) que dependerá de la cantidad
de gas considerado.
Otra forma de expresarlo es la siguiente:
P1V1/T1= P2V2/T2
donde presión, volumen y temperatura se han medido
en dos instantes distintos 1 y 2 para un mismo sistema.
En adición de la ley de Avogadro al rendimiento de la ley de gases combinados
se obtiene la ley de los gases ideales.
Ejercicios de química
Ley de Charles
Para poder realizar los ejercicios vi el siguiente tutorial
Ejercicio #1
Ejercicio # 2
Ejercicio # 3
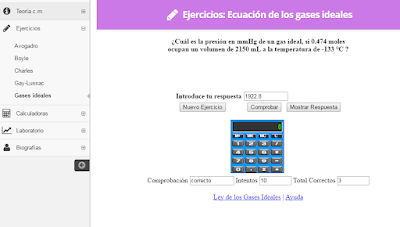
Ley de Gases ideales
Veremos el siguiente tutorial donde nos explican paso a paso
Ejercicio # 1
Ejercicio # 2
Ejercicio 3
Ley de Gay-Lussac
Veamos el siguiente tutorial para poder realizar bien los ejercicios
Ejercicio # 1
Ejercicio # 3
Veremos el siguiente tutorial donde nos explican paso a paso
Ejercicio # 1
Ejercicio # 2
Ejercicio 3
Ley de Gay-Lussac
Veamos el siguiente tutorial para poder realizar bien los ejercicios
Ejercicio # 1
Ejercicio # 2
Ejercicio # 3
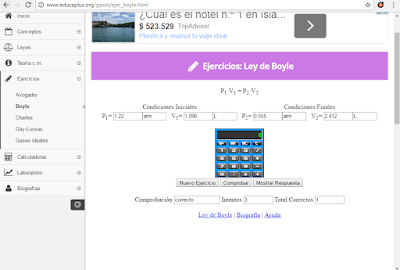
Ley de Boyle
Para poder entender mejor el tema ver el siguiente linke me dio una gran ayuda
Ejercicio # 1
Ejercicio # 2
Ejercicio # 3
Ejercios de Avogadro
Veremos el siguiente link para realizar procesos bien hechos
Ley de Avogadro
a)
b)
c)























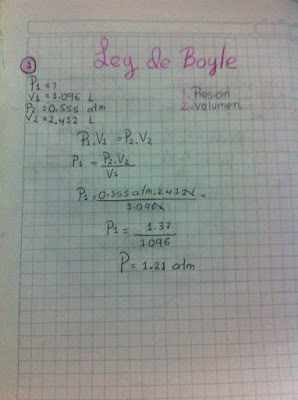










Comentarios
Publicar un comentario